Innovationen im Fokus - Vom heute in die Zukunft: Ideen, Wege, Chancen
Fast schon traditionell standen innovative Glaukom-therapien und deren zukünftige Bedeutung im Mittelpunkt des Symposiums der Glaukos Germany GmbH beim 37. Kon-gress der Deutschen Ophthalmochirurgie 2025 in Nürnberg. Der demografische Wandel – und wie man den damit verbundenen Herausforderungen begegnen kann – zog sich wie ein roter Faden durch die interessanten Beiträge.
Prof. Dr. med. Alireza Mirshahi (Bonn) moderierte die Sitzung und begrüßte die Referenten PD Dr. med. Karl Mercieca (Bonn), Dr. med. Andreas Cordes (Bonn), Prof. Dr. med. Fritz Hengerer (Frankfurt) und Prof. Dr. med. Anselm Jünemann (Erlangen).
Glaukom – Gestern
In den vergangenen Jahrzehnten, begann A. Mirshahi, hat man über den Intraokulardruck (IOD) und das Gesichtsfeld die Diagnose gestellt und damit häufig erst sehr spät in der Kaskade des Glaukoms eingegriffen. Die Therapie begann mit Augentropfen, bei nicht ausreichender Senkung des IOD wurde eine Trabekulektomie (TE) und – wenn das Sickerkissen vernarbte – eine Zyklophotokoagulation durchgeführt, um bei einer erneuten IOD-Erhöhung wieder mit Tropfen zu beginnen. Die Ergebnisse waren schlecht.

Glaukomtherapie – Heute und Morgen
Eine Revolution in der Diagnostik war die optische Kohärenztomografie. Sie ist in der Lage Gangliendefekte zu entdecken und das Glaukom zu diagnostizieren bevor Gesichtsfelddefekte auftreten. In der Therapie kann die selektive Laser Trabekuloplastik (SLT) die Augentropfen als Primärtherapie ergänzen, oder sogar ersetzen. Zuletzt haben Rho-Kinase-Inhibitoren und Stickstoffmonoxid-Donatoren das medikamentöse Therapiespektrum erweitert und minimalinvasive Verfahren erlauben eine frühe chirurgische Intervention. Dazu kommen intrakamerale Medikamententräger wie Durysta (AbbView) oder iDose (Glaukos), die das Nebenwirkungsprofil auf den intraokulären Bereich beschränken und die Behandlung unabhängig von der Compliance der Patienten machen.
Herausforderung Demografie
Schon heute ist die Demografie unser größter Feind, beschrieb A. Mirshahi die gegenwärtige Situation. Er belegte den Fachärztemangel anhand von Zahlen für Sachsen-Anhalt. Für Augenärzte sind 9,5 Stellen frei, dazu kommen über 200 freie Stellen für Hausärzte. Die Schere zwischen Bedarf und Versorgung geht immer weiter auseinander, und das nicht nur in Deutschland, wie eine US-Studie belegt [1].
Glänzende Aussichten
Trotz dieser Herausforderungen habe man in der Glaukomtherapie glänzende Aussichten, resümierte A. Mirshahi. Schon heute wird ein multimodales Screening mit Hilfe von Künstlicher Intelligenz (KI) praktiziert, die KI wird auch die Diagnose und Verlaufskontrolle verbessern. Die Identifizierung von Risikopatienten durch Polygenic Screening* steht kurz vor der Einführung. Die Telemedizin ist auf dem Vormarsch und wird in Sachsen schon praktiziert. Man kann, ohne dass ein Arzt dabei ist, den Visus und die Tensio messen, Papillenfoto, Gesichtsfeld und OCT lassen sich mittels KI auswerten. Frühe Interventionen mit Laser-, MIGS- oder Sustained-Release-Systemen können verhindern, dass ein filtrierender Eingriff notwendig wird. Außerdem wird es multimodale Therapien geben, die Nahrungsergänzungsmittel und die Neuroprotektion beinhalten wird.
Interventional Glaucoma
K. Mercieca praktizierte 16 Jahre in England und widmete sich dem Thema „Interventional Glaucoma“. Es handelt sich dabei um einen proaktiven Behandlungsalgorithmus, mit dem Lösungen für die mit der medikamentösen Therapie verbundenen Probleme gefunden werden sollen, um der Progression der Erkrankung möglichst früh entgegenzutreten.
In den letzten 15 Jahren hat sich, nicht zuletzt dank innovativer minimalinvasiver Techniken, das Therapiespektrum für Glaukompatienten deutlich erweitert. In den LiGHT-Studien wurde eine initiale SLT bei Patienten mit Offenwinkelglaukom oder okulärer Hypertension mit einer topischen Medikation verglichen. Nach 6 Jahren kamen 70 % der Patienten in der SLT-Gruppe ohne zusätzliche Medikamente aus und lagen beim oder unter dem Zieldruck. Bei mehr Patienten, die mit Augentropfen behandelt wurden, schritt die Erkrankung fort (26,8 % vs. 19,6 %) [2]). Basierend auf diesen Ergebnissen betrachten internationale Glaukomgesellschaften die SLT als eine Alternative zu topischen Antiglaukomatosa bei der First-Line-Glaukomtherapie.
Große Studien belegen, dass MIGS-Verfahren in Verbindung mit einer Phakoemulsifikation ein größeres Potential haben, den IOD der Patienten zu senken, als die Phako alleine. Die Drucksenkung einer Kataraktoperation ist abhängig vom Ausgangsdruck und liegt je nach Studiendesign und Nachverfolgungszeitraum zwischen 1,0 mmHg und 5,8 mmHg. Deshalb betrachtet es K. Mercieca als suboptimal, wenn man Glaukompatienten, bei denen eine Phakoemulsifikation durchgeführt werden soll, keine MIGS anbietet.
Gründe für Interventional Glaucoma
Im Wesentlichen nannte K. Mercieca fünf Gründe für den Interventional-Glaucoma-Ansatz (Tabelle 1).
Zum einen ist es die Non-Adhärenz der Glaukompatienten, die wesentlich zur Krankheitsprogression beiträgt. Nach 36 Monaten ist die Tropfenadhärenz auf weniger als ein Drittel gesunken.
| Tabelle 1: Gründe für Interventional Glaucoma |
| Non-Adhärenz |
| Die Anhäufung von Tropfen führt nicht zu besseren Ergebnissen. |
| IOD-Schwankungen |
| Hinweise auf weniger Eingriffe und bessere Stabilität |
| Nachhaltigkeit |
Man weiß inzwischen, dass die zusätzliche Verabreichung von Medikamenten nicht zu einer kumulativen IOD-Senkung führt. In einer US-Studie hat ein drittes Medikament nach 12 Monaten nur bei 23 % der Patienten zu einer IOD-Reduktion von über 20 % geführt.
Fluktuationen und IOD-Spikes sind Risikofaktoren für die Krankheitsprogression. Chirurgische Eingriffe führen im Vergleich zur medikamentösen Behandlung zu signifikant weniger Spitzen beim IOD. Eine Metaanalyse zu Gesichtsfeldveränderungen nach iStent-Implantation bei über 1.000 Patienten ergab eine jährliche Gesichtsfeldveränderung von -0,024 db. Diese Progression ist ver-gleichbar mit Literaturdaten zur Progression von unbehandelten Patienten mit okulärer Hypertension [3].
Laut Umfragen wünschen sich Glaukompatienten wirksame, langanhaltende Therapien mit möglichst wenig Nebenwirkungen und allgemein weniger Arzt-besuche. Arbeitsgruppen in USA und Europa arbeiten derzeit an neuen Algorithmen nach dem Interventional-Glaucoma-Ansatz, um diesen Patientenanforderungen gerecht zu werden.
Auch A. Cordes, niedergelassener Augenarzt in Bonn, sieht im demografischen Wandel den Grund dafür, dass sich immer weniger Ärzte um immer mehr, teils sehr anspruchsvolle Patienten kümmern müssen. Ein Ausweg aus diesem Dilemma sieht er in einem effizienteren Arbeiten mit Fokus auf die Kernkompetenz der Augenärzte – die Patientenversorgung. Dazu hat sich A. Cordes im Bereich Glaukom für eine Herangehensweise nach dem Grundsatz Interventional Glaucoma entschlossen.
Mehr Medikamente – keine gute Strategie
Die zusätzliche Verabreichung von mehr antiglaukomatösen Medikamenten ist keine gute Strategie, führte A. Cordes aus. Eine Analyse der HORIZON- und COMPASS-Studien hat ergeben, dass man mit dem ersten Medikament zwar eine deutliche IOD-Senkung erreicht, mit jedem weiteren Tropfen nimmt der Effekt der Senkung jedoch ab [4)]. Das hat A. Cordes dazu bewogen sein Behandlungsschema zu optimieren. Er beginnt mit einer SLT, ergänzt bei Bedarf mit Medikamenten („Brückentherapie“), um dann einen minimalinvasiven Eingriff durchzuführen. Das Ende der therapeutischen Eskalation ist die fistulierende Operation.
Retrospektiv ergab sich bei diesem Behandlungsalgorithmus eine ausreichend gute IOD-Senkung und eine deutliche Verringerung der einzunehmenden Medikamente.
Weniger Medikamente – weniger Abfall
Neben der Wirksamkeit spielen die Kosteneffizienz und der Umweltaspekt eine wichtige Rolle in der Glaukomtherapie. In den industrialisierten Staaten gehen 7–10 % der Treibhausgasemmissionen auf Kosten des Gesundheitssystems. Die CO2-Emmissionen durch Abfall bei Katarakteingriffen weisen erhebliche regionale Unterschiede auf. Einsparpotenziale liegen beispielsweise in der Nutzung von Mehrwegmaterialen anstelle von Einwegartikeln und speziell bei Glaukom dem Einsatz von weniger Medikamenten, was letztendlich auch zu weniger Abfall führt. Gerade Einmalophthiolen stechen besonders negativ bei der Entstehung von Abfall und der Entstehung von Treibhausgasen hervor.
iStent – kosteneffizient und nachhaltig
Hinsichtlich der Kosteneffizienz bemühte A. Cordes ein statistisches Modell auf Basis seiner eigenen OP-Ergebnisse und errechnete einen Break Even von 6 Jahren – das bedeutet, dass nach ungefähr sechs Jahren der iStent günstiger ist als die klassische medikamentöse Therapie. Betrachtet auf die gesamte Lebenszeit führt das zu einer Ersparnis von etwa 1.000 Euro pro Patient und es treten weitere positive Sekundäreffekte ein: geringere Druckschwankungen, weniger Medikamente und weniger Sekundär-eingriffe. Diese Effekte sind auch unter wirtschaftlichen Aspekten beachtlich. Bei den eigenen Versorgungsdaten brachte die Umstellung auf die Behandlung mittels SLT und iStent einen deutlichen Rückgang sowohl bei der Verordnung von Glaukommedikamenten hinsichtlich ihrer Anzahl, als auch grundsätzlich der Anzahl an Patienten, die überhaupt Antiglaukomatosa verordnet bekommen müssen. Mit dem lateinischen Sprichwort „Die Zeiten ändern sich und wir mit ihnen“ schloss A. Cordes seinen interessanten Beitrag.
10-Jahresdaten iStent inject
Als 2015 das iStent inject-System in Deutschland verfügbar wurde, war F. Hengerer, damals noch in Heidelberg, einer der ersten, der die Stents seinen Glaukompatienten angeboten hat. Beim Kongress der ASCRS 2025 in Los Angeles hat er beeindruckende Langzeitdaten zum iStent inject vorgestellt [5].
Insgesamt wurden 125 Augen in die prospektive konsekutive Fallserie eingeschlossen. 81 Augen erhielten den iStent inject im Rahmen einer Kataraktoperation implantiert (Kombination), 44 Augen erhielten den iStent inject im Stand-alone-Verfahren. Charakteristisch für beide Patientengruppen war die hohe präoperative Medikamentenbelastung (62 % Patienten mit 3–4 Medikamenten) und der hohe Anteil voroperierter Augen (38 %). Nach 10 Jahren konnten noch 58 Augen ausgewertet werden. Die Gesamtkohorte verzeichnete einen IOD-Rückgang von über 40 % auf durchschnittlich 14,1 mmHg. Die Anzahl IOD-senkender Medikamente verringerte sich von 2,7 auf 1,10 (Abbildung 1). Im gesamten Nachbeobachtungszeitraum wurde bei nur 7 Augen ein nichtfiltrieren-der IOD-senkender Eingriff notwendig.
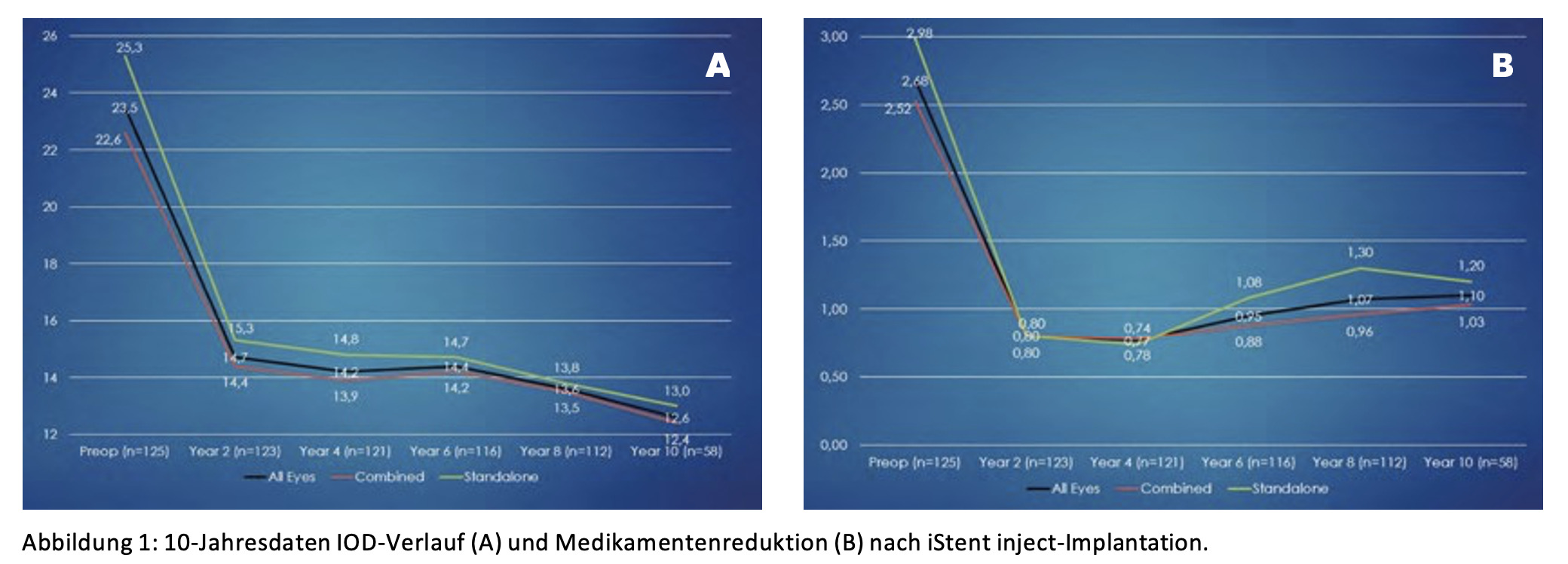
Abbildung 1: 10-Jahresdaten IOD-Verlauf (A) und Medikamentenreduktion (B) nach iStent inject-Implantation.
iStent infinite – iStent der 3. Generation
Beim iStent infinite-System handelt es sich um einen mit 3 iStent inject W beladenen Injektor. Die Zulassung durch die FDA erfolgte 2022. In der prospektiven multizentrischen US-Zulassungsstudie wurden 72 Patienten mit unkontrolliertem Offenwinkelglaukom mit dem iStent infinite behandelt. 61 Patienten waren mehrfach vergeblich voroperiert, 11 Patienten mussten präoperativ durchschnittlich 4,1 IOD-senkende Medikamente einnehmen. Nach einem Jahr hatten 79 % der Patienten eine IOD-Senkung von über 20 %, die Medikamentenbelastung konnte auf 2,7 Tropfen reduziert werden [6]. Die Zwischenauswertung einer retrospektiven Fallserie mit 345 Patienten mit unkontrollierten Offenwinkelglaukom bestätigten die Ergebnisse der Zulassungsstudie. Sowohl der IOD als auch die Medikamentenbelastung wurden signifikant reduziert.
iStent infinite – 3 Stents, unendlich viele Auslösemechanismen
In Anlehnung an die von F. Hengerer vor-gestellten Daten präsentierte A. Jünemann das iStent infinite-System. Es handelt sich dabei nicht um einen neuen Stent, betonte er, sondern um einen Injektor, mit dem 3 iStent inject W implantiert werden können (Abbildung 2). Darüber hinaus stehen mit dem neuen Injektor – anders als bei den Vorgängermodellen – eine unendliche Anzahl an Auslösemechanismen zur Verfügung. Glaukomchirurgie gibt es schon seit über 3 Jahrhunderten und auch die minimal-invasive Glaukomchirurgie blickt auf 20 Jahre zurück. Anhand von Videos zeigte A. Jünemann die Entwicklung der verschiedenen iStent-Modelle: vom G1, dem ersten iStent, über iStent inject und iStent inject W hin zum iStent infinite.
Neue Features: iStent infinite-Injektorsystem

Besonders hob A. Jünemann nach seinen Erfahrungen aus dem Dry Lab die neuen Features des Injektors hervor (Abbildung 3). Dazu zählt der Auslöseknopf, der eine präzise Stent-Platzierung mit unendlichen Auslösemöglichkeiten bietet. Eine sich automatisch zurückziehende Schutzhülle verhindert den Austritt von Viskoelastikum während der Implantation, der abgewinkelte Einführtubus bietet einen besseren Zugang, das Sichtfenster eine optimale Visualisierung und das ergonomisch geformte Handstück mehr Kontrolle während der Operation. Das Operationsvideo eines amerikanischen Kollegen rundete die Präsentation ab.
MDR-Zertifizierung 2025
Nach der FDA-Zulassung 2022 hat das iStent infinite-System im Juni 2025 die EU-MDR Zertifizierung erhalten. Das trabekuläre Mikro-Bypass System ist bei Patienten mit mittelschwerem und fortgeschrittenem Glaukom und hoher präoperativer Belastung indiziert. Es kann sowohl im Rahmen einer Kataraktoperation, als auch als alleiniger Eingriff zur effektiven Verringerung des Intraokulardrucks angewendet werden.
Die Videos zu dem Vorträgen sehen Sie hier.
* Der polygene Risikoscore (PRS) ist ein Verfahren zur Bestimmung der genetischen Anfälligkeit eines Individuums für bestimmte Krankheiten.
Literatur
1. Berkowitz ST, Finn AP, Parikh R et al (2024) Ophthalmology workforce projections in the United States, 2020 to 2035. Ophthalmol 131: 133–139
2. Gazzard G, Konstantakopoulou E, Garway-Heath D et al (2023) Laser in Glaucoma and Ocular Hypertension (LiGHT) Trial: Six-year results of primary selective laser trabeculoplasty versus eye drops for the treatment of glaucoma and ocular hypertension. Ophthalmol 130: 139–151
3. Gillmann K, Hornbeak DM (2024) Rates of visual field change and functional progres-sion in glaucoma following trabecular micro-bypass implantation of iStent technologies: a meta-analysis. BMJ Open Ophthalmol 9: e001575
4. Johnson TV, Jampel HD (2020) Intraocular pressure following prerandomization glau-coma medication washout in the HORIZON and COMPASS trials. Am J Ophthalmol116: 110–120
5. Hengerer FH, Auffarth GU, Conrad-Hengerer I (2025) Sustained 10-year glaucoma con-trol after second generation trabecular micro-bypass surgery with or without cata-ract surgery. Vortrag ASCRS Los Angeles, USA
6. Sarkisian SR, Ang RE, Lee AM et al (2024) Travoprost intracameral implant for open-angle glaucoma or ocular hypertension: 12-month results of a randomized, double-masked trial. Ophthal Ther 13: 995–1014