Glaukos verkündet FDA-Zulassung von iDose® TR (Travoprost-Intrakameral-Implantat)
Revolutionäres, mikroinvasives, implantierbares Release-System für das gesamte Spektrum der Glaukom-Schweregrade | iDose TR leitet neue Ära der interventionellen Glaukombehandlung ein
Die Glaukos Corporation hat bekannt gegeben, dass die US-amerikanische Food and Drug Administration (FDA) ihre New Drug Application (NDA) für eine einmalige Verabreichung pro Auge von iDose® TR (Travoprost-Intrakameral-Implantat) 75 mcg zur Senkung des Augeninnendrucks (IOD) bei Patienten mit okulärer Hypertonie (OHT) oder Offenwinkelglaukom (OWG), genehmigt hat.
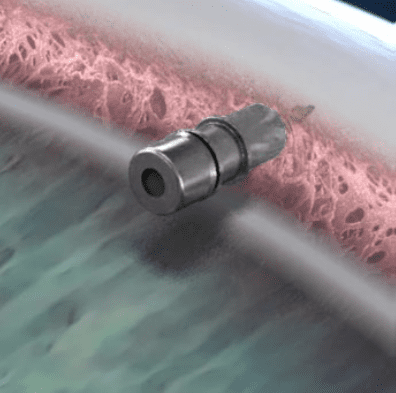
iDose TR (Travoprost-Intrakameral-Implantat) ist ein Prostaglandin-Analogon mit langer Wirkdauer, das für eine einmalige Verabreichung zugelassen ist und zur Senkung des Augeninnendrucks (IOD) bei Patienten mit Offenwinkelglaukom (OWG) oder okulärer Hypertonie (OHT) indiziert ist. Hergestellt aus medizinischem Titan wird iDose TR durch das Trabekelnetzwerk und die hintere Wand des Schlemm-Kanals direkt ins Skleragewebe implantiert. Nach der Implantation gibt iDose TR kontinuierlich 75 mcg einer neuartigen, konservierungsmittelfreien, proprietären Formulierung von Travoprost über membrangesteuerte Diffusion in die Vorderkammer ab, was eine rund um die Uhr erfolgende Medikamentenfreisetzung ermöglicht.
iDose TR soll den Behandlungsstandard verbessern, indem es die weit verbreiteten Probleme der Patienten-Compliance und chronischen Nebenwirkungen von topischen Glaukommedikamenten angeht.
Die FDA-Zulassung basiert auf den Ergebnissen von zwei prospektiven, randomisierten, multizentrischen, doppelt maskierten Phase-3-Pivotalstudien (GC-010 und GC-012), die darauf abzielten, die Sicherheit und Wirksamkeit einer einmaligen Verabreichung von zwei iDose TR-Modellen mit unterschiedlichen Travoprost-Freisetzungsrate (schnell- und langsamfreisetzendes iDose TR-Modell) im Vergleich zu Timolol-Augentropfen, 0,5% BID (zweimal täglich), zur Senkung des Augeninnendrucks bei Patienten mit Offenwinkelglaukom oder okulärer Hypertonie zu vergleichen. Insgesamt wurden in den Phase-3-Studien 1.150 Probanden an 89 klinischen Standorten randomisiert. Die FDA-Zulassung bezieht sich auf das langsamfreisetzende iDose TR-Modell, im Einklang mit der NDA-Einreichung des Unternehmens und den Vermarktungsplänen.
Beide Phase-3-Studien erreichten erfolgreich die vordefinierten primären Wirksamkeitsendpunkte nach 3 Monaten und zeigten ein günstiges Verträglichkeits- und Sicherheitsprofil nach 12 Monaten. Die Senkungen des Augeninnendrucks vom Ausgangswert über die ersten 3 Monate betrugen 6,6-8,4 mmHg im iDose TR-Arm gegenüber 6,5-7,7 mmHg im Timolol-Kontrollarm (der mmHg-Bereich repräsentiert die IOD-Reduktionsmittelwerte über die sechs vom US-amerikanischen FDA vorab festgelegten Zeitpunkte um 8 Uhr und 10 Uhr an Tag 10, Woche 6 und Monat 3). Auf der Grundlage dieser Ergebnisse kam die FDA in der Fachinformation zu dem Schluss, dass iDose TR in Bezug auf die Senkung des Augeninnendrucks in den ersten drei Monaten Timolol ophthalmischer Lösung nicht unterlegen ist. Die FDA stellte auch fest, dass iDose TR anschließend in den nächsten 9 Monaten keine Nichtunterlegenheit zeigte.
Nach 12 Monaten waren 81% der iDose TR-Teilnehmer in beiden Studien vollständig frei von IOD-senkenden topischen Medikamenten. In beiden Studien zeigte iDose TR eine ausgezeichnete Verträglichkeit und Teilnehmerbindung, wobei 98% der iDose TR-Teilnehmer nach 12 Monaten weiterhin an der Studie teilnahmen, im Vergleich zu 95% der Timolol-Kontrollteilnehmer. In kontrollierten Studien wurden die häufigsten okularen unerwünschten Reaktionen, die bei 2% bis 6% der iDose TR-Patienten berichtet wurden, Erhöhungen des Augeninnendrucks, Iritis, trockenes Auge und Gesichtsfelddefekte, von denen die meisten mild und vorübergehend waren.
iDose TR wird auch durch positive Ergebnisse aus einer Phase-2b-Klinischen Studie unterstützt, die kürzlich in einer Peer-Review-Publikation in Drugs hervorgehoben wurde. Die Autoren der Studie kamen zu dem Schluss: „Das Travoprost-Intraokularimplantat zeigte robuste Senkungen des Augeninnendrucks und eine wesentlich reduzierte Belastung durch topische Augeninnendrucksenkende Medikamente für bis zu 36 Monate nach einer einmaligen Verabreichung, bei gleichzeitig günstigem Sicherheitsprofil.“
Glaukos beabsichtigt, im späteren Teil des ersten Quartals 2024 mit den ersten kommerziellen Startaktivitäten für iDose TR zu beginnen. Glaukos hat einen Großhandelskostenpreis für iDose TR von 13.950 USD pro Dosis (oder Implantat) festgelegt.
„Die FDA-Zulassung von iDose TR stellt einen bedeutenden Meilenstein für Glaukos dar, nach einer umfangreichen Pionierarbeit seit der Entstehung der ursprünglichen Idee vor fast 15 Jahren. Die heutige Zulassung leitet eine neue Ära der interventionellen Glaukomtherapie ein, indem sie einen proaktiveren und zuverlässigeren Ansatz für Patienten ermöglicht“, sagte Thomas Burns, Vorsitzender und CEO von Glaukos.
„Mittels der nächsten Generation prozeduraler pharmazeutischer Lösungen für das Glaukom wie iDose TR haben wir nun ein neues Werkzeug, das sich dem traditionellen Praxisansatz, auf topische Tropfen zu setzen, entgegenstellt, die für unangenehme Nebenwirkungen bekannt sind und zahlreiche Herausforderungen wie Therapietreue, komplexe Dosierungspläne und Schwierigkeiten bei der Selbstverabreichung mit sich bringen“, sagte John Berdahl, MD, Kliniker und Forscher bei Vance Thompson Vision. „Die klinischen Daten legen nahe, dass iDose TR nicht nur wirksam mit einem günstigen Sicherheitsprofil ist, sondern auch das Potenzial hat, Patienten für eine verlängerte Zeit von den Belastungen verschreibungspflichtiger Augentropfen zu befreien. Ich freue mich darauf, diese neuartige Therapie zu meinem Behandlungswerkzeug für das Wohl meiner Patienten hinzuzufügen.“
Parallel zur iDose TR-Zulassungsankündigung freut sich Glaukos, die „iDose Your Dose“-Initiative vorzustellen. Für jede verkaufte iDose TR verpflichtet sich Glaukos, eine gleiche Anzahl von iDose TR-Einheiten für qualifizierte Spendenanfragen in den USA und weltweit zur Verfügung zu stellen, die unabhängige Berechtigungsanforderungen erfüllen.
Für weitere Informationen zu iDose TR und der vollständigen Verschreibungsinformation besuchen Sie bitte iDoseTRhcp.com.