IVOM-Update: Faricimab in den USA zugelassen & das Port-Delivery-System mit Ranibizumab
Die intravitreale operative Medikamenteneingabe (IVOM) hat die Therapie von Netzhauterkrankungen revolutioniert. Doch die häufig über Jahre erfolgenden Injektionen stellen eine große Belastung dar – für Patienten und Praxen. Gesucht werden deshalb Behandlungsmöglichkeiten mit einer längeren Wirkdauer. Wie etwa der gerade von der FDA zugelassene Antikörper Faricimab oder das Port-Delivery-System mit Ranibizumab.
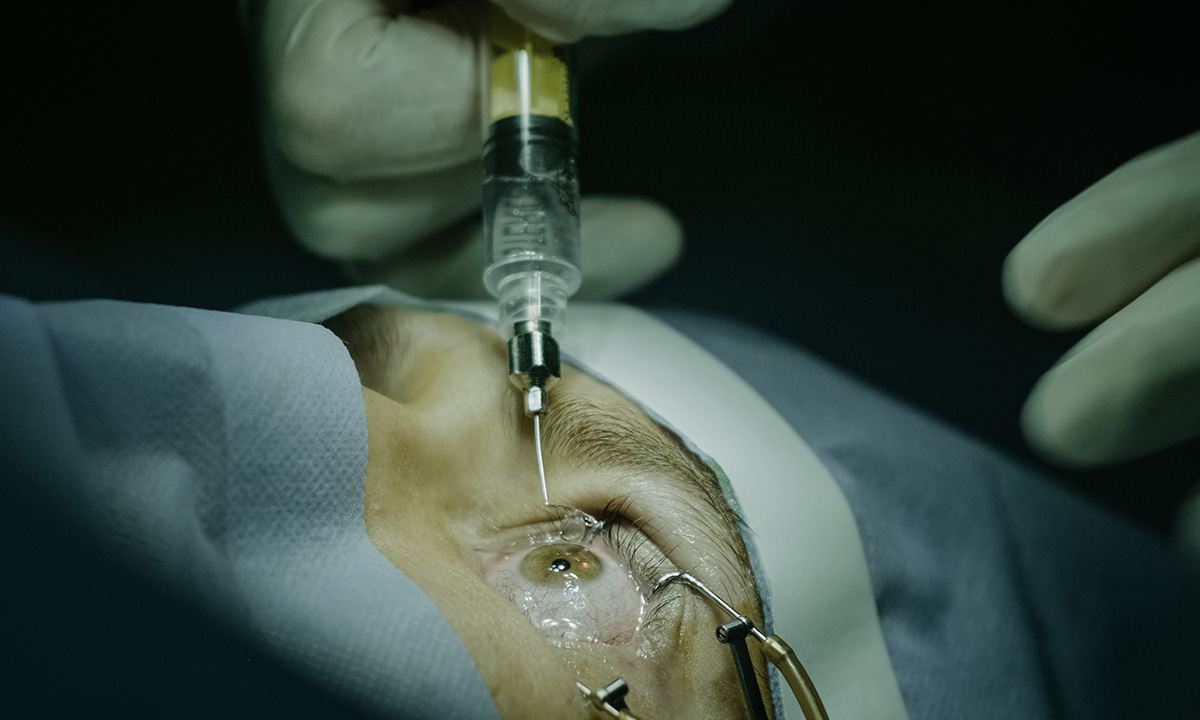
Es ist eine wirkliche Erfolgsgeschichte: Die durch neovaskuläre AMD (nAMD) verursachte Blindheit ist seit Einführung der Angiogenesehemmer vor über 15 Jahren um etwa 50 bis 70 % zurückgegangen. Die ersten in Deutschland für eine Injektion in den Glaskörper zugelassenen Wirkstoffe waren Ranibizumab (Lucentis / Ersteinführung 2007) und Aflibercept (Eylea / Ersteinführung 2012). Seit Februar 2020 ist auch Brolucizumab (Beovu) zugelassen. Off-Label wird auch Bevacizumab (Avastin) eingesetzt.
Strategien zur Verlängerung der Behandlungsintervalle
Zeitaufwand und Kosten für die regelmäßige IVOM sind erheblich. Die Häufigkeit richtet sich nach dem Verlauf der Erkrankung, weshalb engmaschige Nachkontrollen und Wiederbehandlungen erfolgen müssen – und das über Jahre hinweg. Für Patienten, ihre Angehörigen und die Kliniken und Praxen stellt das eine immense Belastung dar. Doch die lückenlose Betreuung der Patienten ist essenziell für den Therapieerfolg. So wurde mit engmaschigen Nachkontrollen und Wiederbehandlungen im Rahmen verschiedener Zulassungsstudien zur IVOM-Therapie bei nAMD in den ersten zwei Jahren im Mittel eine deutliche Visusverbesserung erzielt. Doch ein Abweichen von idealen Therapieintervallen wegen versäumter Folgetermine oder zu langen Zeiträumen zwischen den Behandlungsterminen kann einen irreversiblen Visusverlust nach sich ziehen. Um die Adhärenz der Patienten zu steigern, werden Behandlungen mit verlängerten Applikationsintervallen gesucht, was Patienten, aber auch Ärzten, die Behandlung erleichtern würde.
Port-Delivery-System (PDS) mit Ranibizumab
Vielversprechend ist das Port-Delivery-System (PDS) mit Ranibizumab, zu dem jetzt auch in Europa die erste Studie läuft. Dieses permanente Implantat knüpft an erfolgreiche Therapieansätze der okulären Drug Delivery an: den Dexamethason-Medikamententräger Ozurdex und das mit Fluocinolonacetonid gefüllte Mikroröhrchen Iluvien.
Das reiskorngroße PDS wird operativ über die Pars Plana eingesetzt und ist durch seine extrasklerale Verbindung in der Sklera verankert. Es besteht aus einem selbstverschließenden Septum aus Silikon für die Wiederbefüllungen, einem Reservoir aus Polysulfon sowie einem Release Control Element aus medizinischem Titan. Das Metall wurde so bearbeitet, dass es eine definierte Porengröße besitzt, durch die das Ranibizumab mittels passiver Diffusion in den Glaskörper abgegeben wird. Die Konzentration liegt bei 100 mg/ml und ist damit sehr viel höher als die bei monatlicher Gabe von Ranibizumab maximal erreichbare Konzentration im Glaskörper. Das Arzneimittel im Reservoir wird alle 24 oder 36 Wochen ersetzt bzw. wiederbefüllt. Beim Refill wird das Septum des Implantats durchstochen. Ein spezielles Verfahren stellt den Austausch von 98 % sicher, wobei der Austauschprozess nur 5 bis 10 Sekunden dauert.
Die Ergebnisse der Archway Phase III Studie zeigen: Bei Patienten mit nAMD, die auf Anti-VEGF ansprachen, sind die Ergebnisse einer PDS-Behandlung funktionell als auch anatomisch gleichwertig wie bei Patienten mit monatlichen Ranibizumab-Injektionen. Die mittlere Anzahl der Behandlungen einschließlich Erst- und Nachbefüllungen und zusätzlichen Injektionen lag in der PDS-Gruppe bei 3,9, in der Gruppe mit den monatlichen IVOM bei 19,5 Terminen. Die Behandlungslast war bei einem guten Sicherheitsprofil also deutlich verringert. Im Rahmen der globalen VELODROME-Studie steht das PDS mittlerweile auch in Deutschland Patienten zur Verfügung.
Faricimab erhält FDA-Zulassung
Auch Faricimab soll sich durch ein längeres Dosierungsintervall auszeichnen. Der bispezifische Antikörper erhielt gerade von der US-Arzneimittelbehörde FDA die Zulassung und wird in den kommenden Wochen in den USA erhältlich sein. Eine Zulassung durch die Europäische Arzneimittelagentur EMA wird bis Ende 2023 erwartet. Vabysmo, so der Name des Medikaments des in San Francisco ansässigen Biotechnologie-Unternehmens Genentech, einem Tochterunternehmen von Roche, ist für die Behandlung von nAMD und des diabetischen Makulaödems (DMÖ) zugelassen. Als bislang einziger bispezifischer Antikörper wurde er speziell für das Auge, genauer die intravitreale Anwendung entwickelt.
Im Gegensatz zu den derzeitigen Therapien für nAMD und DMÖ, die nur den VEGF-Signalweg hemmen, zielt Faricimab zusätzlich auch auf Angiopoietin-2 ab. Beide Signalwege, Angiopoietin-2 (Ang-2) und der vaskuläre endothelialen Wachstumsfaktor-A (VEGF-A), destabilisieren die Blutgefäße, regen die Bildung neuer undichter Blutgefäße an und verstärken Entzündungen. Durch die gleichzeitige Blockade beider Signalwege soll Faricimab die Blutgefäße stabilisieren. Ungefähr die Hälfte der Patienten, die den Antikörper erhielten, mussten dabei laut Hersteller nach zunächst 4 monatlichen Dosen nur noch alle 4 Monate behandelt werden.
Quellen / weitere Informationen
Anti-VEGF-Langzeittherapie der neovaskulären AMD mit dem Port-Delivery-System
FDA Approves Genentech’s Vabysmo