Protein Tenascin-C: Ein Biomarker für die Früherkennung retinaler Ischämien?
Zahlreiche Augenerkrankungen gehen mit Ischämien einher, die bis zur Erblindung führen können. Welche Rolle das Protein Tenascin-C, ein Bestandteil der extrazellulären Matrix, bei der Minderdurchblutung der Retina spielt, untersuchten Forscherinnen der Ruhr-Universität Bochum (RUB) an Mäusen. Sie zeigten, dass Tenascin-C eine entscheidende Rolle bei der Schädigung von Sehsinneszellen nach Ischämien spielt.

Tenascin-C nach Minderdurchblutung der Netzhaut
Ischämien entstehen durch eine Unterbrechung der Blut- und Nährstoffversorgung in der Netzhaut – ähnlich wie bei einem Schlaganfall. In der Folge sterben Sehsinneszellen ab, was zu Sehstörungen und sogar zur Erblindung führen kann. Das Forschungsteam zeigte bei Mäusen, dass Netzhautzellen sehr früh nach einer Ischämie verstärkt Tenascin-C bilden. Im weiteren Verlauf des retinalen Schadens verringert sich die Menge des Proteins dann wieder. „Tenascin-C könnte somit ein Biomarker für die Früherkennung ischämischer Augenerkrankungen sein“, sagt Jacqueline Reinhard vom Lehrstuhl für Zellmorphologie und Molekulare Neurobiologie der RUB.
Verbesserte Netzhautfunktion in Mäusen ohne Tenascin-C nach Ischämie
Die Wissenschaftlerinnen führten auch sogenannte Elektroretinogramm-Analysen durch, mit deren Hilfe sie den elektrischen Signalfluss der Netzhaut nach einem Lichtimpuls messen konnten. So zeigten sie, dass eine retinale Minderdurchblutung bestimmte Zelltypen in der Netzhaut funktionell beeinträchtigt: zum einen die Stäbchen-Fotorezeptoren als auch die in der Sehverarbeitung nachgeschalteten Bipolarzellen.
Bei genetisch veränderten Mäusen, die kein Tenascin-C bilden konnten, funktionierten die Sehsinneszellen der Netzhaut deutlich besser nach einer ischämischen Schädigung als bei Kontrolltieren, die Tenascin-C besaßen. Außerdem starben ohne Tenascin-C weniger Stäbchen-Fotorezeptorzellen ab.
|
Mögliche Veränderungen zwischen den Kontaktstellen der Nervenzellen Des Weiteren wiesen die Wissenschaftlerinnen erhöhte Level des vesikulären Glutamat-Transporters vGlut1 in der minderdurchbluteten Netzhaut nach. „Diese könnten mit einer beeinträchtigten synaptischen Signalübertragung zwischen den Zellen zusammenhängen und zum Zelluntergang als Folge des Augeninfarkts beitragen. Tenascin-C könnte hier ein wichtiger Modulator sein“, vermutet Jacqueline Reinhard. „Auf Basis dieser Erkenntnisse können zukünftig neue Ansätze erforscht werden, um den Therapieerfolg des Augeninfarkts weiter zu verbessern.“ Im Rahmen der Forschungsarbeit kooperierte das Team um Dr. Susanne Wiemann und Dr. Jacqueline Reinhard vom Lehrstuhl für Zellmorphologie und Molekulare Neurobiologie der RUB mit der Arbeitsgruppe von Prof. Dr. Stephanie Joachim des Experimental Eye Research Institute der Universitäts-Augenklinik in Bochum. Die Ergebnisse veröffentlichte das Team in der Zeitschrift Frontiers in Neuroscience, online am 20. Mai 2021. |
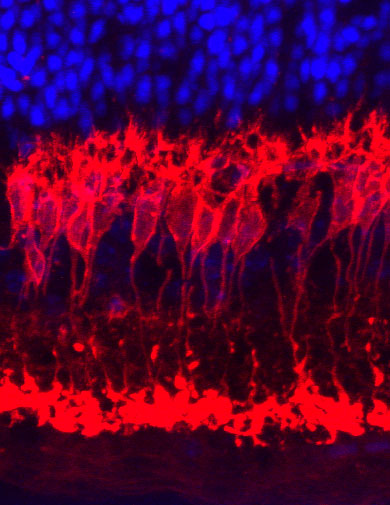 ©RUB Netzhaut nach ischämischer Schädigung. Aufgenommen mit einem Laserscanning-Mikroskop. Rot: Bipolarzellen, die nach der Ischämie funktionell stark beeinträchtigt sind. Blau: Kerne der Photorezeptorzellen, die nach Ischämie ebenfalls funktionell geschädigt sind. |
Originalveröffentlichung
Susanne Wiemann, Aisha Yousf, Stephanie C. Joachim, Carolin Peters, Ana M. Mueller-Buehl, Natalie Wagner, Jacqueline Reinhard: Knock-out of tenascin-C ameliorates ischemia-induced rod-photoreceptor degeneration and retinal dysfunction, in: Frontiers in Neuroscience, 2021, DOI: 10.3389/fnins.2021.642176
Quelle: Ruhr-Universität Bochum