Geschädigte Mitochondrien: Wie Zellen ihre Kraftwerke reparieren
Forschende der Heinrich-Heine-Universität Düsseldorf (HHU) und der Universität zu Köln um HHU-Medizinprofessor Dr. David Pla-Martín beschreiben in der Fachzeitschrift Science Advances, wie Zellen mit schadhaften Mitochondrien ein spezielles Recyclingsystem aktivieren, um beschädigtes genetisches Material zu beseitigen.
Ist das genetische Material von Mitochondrien – die mitochondriale DNA oder kurz mtDNA – geschädigt, können dadurch Krankheiten wie Parkinson, Alzheimer, amyotrophe Lateralsklerose (ALS), Herz-Kreislauf-Erkrankungen und Typ-2-Diabetes entstehen. Mitochondriale Dysfunktionen können auch zu ophthalmologischen Beeinträchtigungen führen. So entstehen primäre mitochondriale Erkrankungen wie die Leberʼsche hereditäre Optikusatrophie (LHON), die Retinitis pigmentosa und die chronisch progressive externe Ophthalmoplegie als Folge von direkten Schädigungen der mitochondrialen Funktion durch defekte Gene auf der mtDNA oder auf der nukleären DNA (nDNA). Überdies beschleunigt eine solche Schädigung den Alterungsprozess. Doch die Zellen sind normalerweise in der Lage, solche Schäden zu erkennen und darauf zu reagieren.
Mechanismus, der Mitochondrien schützt und repariert
Wissenschaftlerinnen und Wissenschaftler des Universitätsklinikums Düsseldorf und der HHU haben in Zusammenarbeit mit der Universität zu Köln und dem Zentrum für Molekulare Medizin Köln (ZMMK) einen Mechanismus entdeckt, der Mitochondrien schützt und repariert. Das Forschungsteam unter der Leitung von Prof. Pla-Martín vom Institut für Biochemie und Molekularbiologie I der HHU identifizierte ein spezialisiertes Recyclingsystem, das Zellen aktivieren, wenn sie eine Schädigung der mtDNA feststellen.
Dieser Mechanismus stützt sich, so die Autorinnen und Autoren in Science Advances, auf einen Proteinkomplex namens Retromer und die Lysosomen – Zellorganelle, die Verdauungsenzyme enthalten. Diese speziellen zellulären Kompartimente wirken wie Recyclingzentren, die das beschädigte genetische Material beseitigen. Dieser Prozess ist einer der Mechanismen, die verhindern, dass sich fehlerhafte mtDNA anhäuft. Er erhält somit die zelluläre Gesundheit und beugt möglicherweise Krankheiten vor.
Bisher unbekannter zellulärer Weg identifiziert
„Wir haben einen bisher unbekannten zellulären Weg identifiziert, der für die Gesundheit der Mitochondrien und damit für die natürlichen Abwehrkräfte unserer Zellen wichtig ist“, erklärt Prof. Pla-Martín und fährt fort: „Indem wir diesen Mechanismus verstehen, können wir uns erklären, wie mitochondriale Schäden Krankheiten wie Parkinson und Alzheimer auslösen. Dies wiederum kann die Grundlage sein, um präventive Therapien zu entwickeln.“
In Zusammenarbeit mit der Zellbiologin Dr. Parisa Kakanj von der Universität zu Köln, die auch Mitglied des Exzellenzclusters CEPLAS ist, konnte Pla-Martín anhand des Modellorganismus der Fruchtfliege (Drosophila) die Erkenntnisse überprüfen und erweitern. Dr. Kakanj zeigte, dass geschädigte mitochondriale DNA deutlich beschleunigt beseitigt werden und sich die mitochondriale Funktion erheblich verbessert, wenn die Aktivität des Retromer-Komplexes – insbesondere des Proteins VPS35 – gesteigert wird.
Deutliche Verbesserungen der mitochondrialen Gesundheit
Kakanj: „Mithilfe von Drosophila konnten wir unsere ersten Ergebnisse an menschlichen Zellen bestätigen und deutliche Verbesserungen der mitochondrialen Gesundheit nachweisen. Hiermit eröffnen sich spannende Möglichkeiten für therapeutische Strategien, um mitochondriale Krankheiten und altersbedingte Leiden zu behandeln.“
Relevanz für die Augenheilkunde
Zur Frage, inwieweit diese ersten Ergebnisse auch für Augenerkrankungen von Relevanz sind, erklärt Prof. Pla-Martín: „Unsere Ergebnisse sind aus präklinischer Sicht äußerst vielversprechend. Mutationen im Gen, das für VPS35 kodiert, verursachen seltene Formen der Parkinson-Krankheit, bei der ebenfalls eine Anhäufung von mtDNA-Schäden beobachtet wird. In diesem Zusammenhang laufen derzeit klinische Studien, in denen untersucht wird, ob eine Modulation des Retromers positive Effekte auf die Parkinson-Erkrankung hat. Könnte dies auch für mitochondriale Augenerkrankungen gelten? Möglicherweise ja. Wir gehen davon aus, dass eine Steigerung der Retromer-Aktivität zur Verbesserung der mitochondrialen Qualitätskontrolle beitragen könnte. Dies würde bedeuten, dass geschädigte Mitochondrien schneller entfernt und so die zelluläre Homöostase wiederhergestellt werden kann. Ein nächster logischer Schritt wäre ein Substanzscreening, um natürliche Aktivatoren des Retromers zu identifizieren. Darauf aufbauend könnten diese Wirkstoffe in Modellen für mitochondriale Augenerkrankungen oder andere mitochondriale Störungen getestet werden – ein sehr spannender und vielversprechender Ansatz.“
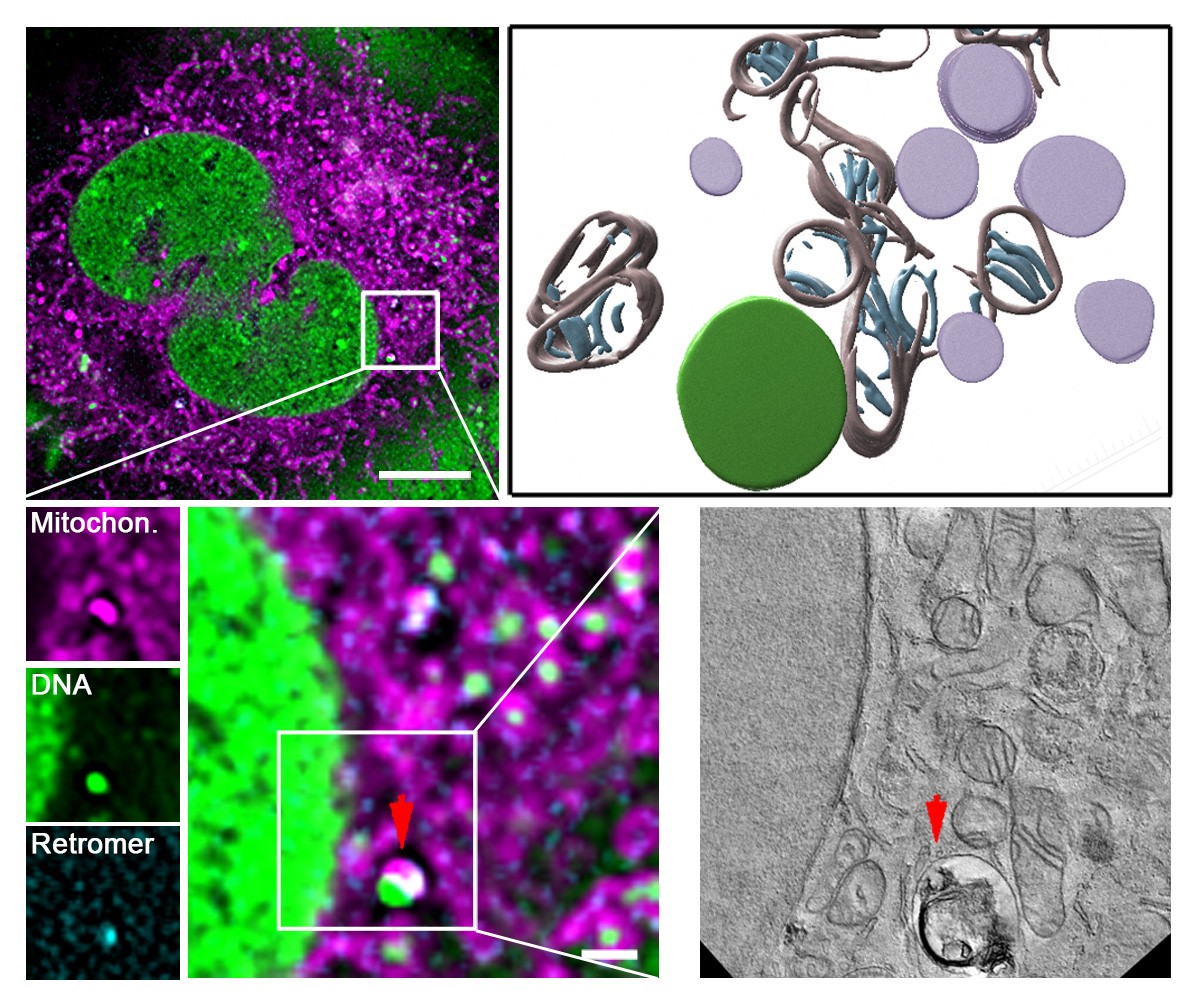
Aufnahmen mit der sogenannten Correlative Light and Electron Microscopy (kurz CLEM) einer Zelle unter mtDNA-Replikationsstress. Die mitochondriale DNA (mtDNA, grün) wird aus den Mitochondrien (magenta) ausgestoßen und von einem Lysosom aufgenommen, das den Retromer (cyan) enthält. Der hervorgehobene Ausschnitt wurde zudem mit 3D-CLEM analysiert, um volumetrische Informationen zu gewinnen. (Abbildung: HHU / David Pla-Martín)
Quelle: Heinrich-Heine-Universität Düsseldorf
Originalpublikation:
Parisa Kakanj, Mari Bonse, Arya Kshirsagar, Aylin Gökmen, Felix Gaedke, Ayesha Sen, Belén Mollá, Elisabeth Vogelsang, Astrid Schauss, Andreas Wodarz, David Pla-Martín. Retromer promotes the lysosomal turnover of mtDNA. Science Advances (2025).