Blick ins Auge erklärt Krankheitsmechanismen der Schizophrenie
Forschende des Max-Planck-Instituts (MPI) für Psychiatrie analysierten den Zusammenhang von Netzhautzellen und neuropsychiatrischen Erkrankungen. Durch die Kombination verschiedener Datensätze fanden sie heraus, dass Schizophrenie-Risikogene mit bestimmten Nervenzellen in der Netzhaut zusammenhängen.

Die Risikogene scheinen die Fähigkeit der Neuronen, miteinander zu kommunizieren, zu beeinträchtigen. Das könnte auch im Gehirn von Schizophrenie-PatientInnen so sein.
Veränderungen in der Netzhaut von Schizophrenie-PatientInnen
Die Netzhaut ist entwicklungsbiologisch ein Teil des Gehirns und hat die gleiche Genetik. Für Forschende wird die Netzhaut neuerdings als eine leicht zugängliche Alternative verwendet, um Gehirnerkrankungen zu untersuchen. Die Projektgruppe Translational Deep Phenotyping des Max-Planck-Instituts (MPI) für Psychiatrie, geleitet von Florian Raabe, fand schon in einer früheren Studie Veränderungen in der Netzhaut von Schizophrenie-PatientInnen. Diese nahmen mit erhöhtem genetischem Risiko zu. Die WissenschaftlerInnen vermuteten daher, dass Netzhautveränderungen auch durch die Krankheitsmechanismen der Schizophrenie verursacht werden und nicht nur durch häufige Begleiterkrankungen wie Adipositas oder Diabetes.
Wenn das der Fall ist, könnten Netzhautveränderungen Einblicke in die biologischen Mechanismen der Erkrankung geben. Neben der Schizophrenie wurden Netzhautveränderungen auch bei PatientInnen mit bipolarer Störung, Depression, Multipler Sklerose (MS), Alzheimer, Parkinson und Schlaganfall beobachtet. Raabe und Erstautor Emanuel Boudriot (MPI für Psychiatrie und LMU München) nutzten nun Ergebnisse aus großen, bereits publizierten Studien, um Daten zu Risikogenen neuropsychiatrischer Erkrankungen mit RNA-Sequenzierungsdaten aus der Netzhaut zu kombinieren. Das zeigte, welche Risikogene der oben genannten Erkrankungen mit verschiedenen Netzhautzellen assoziiert sind.
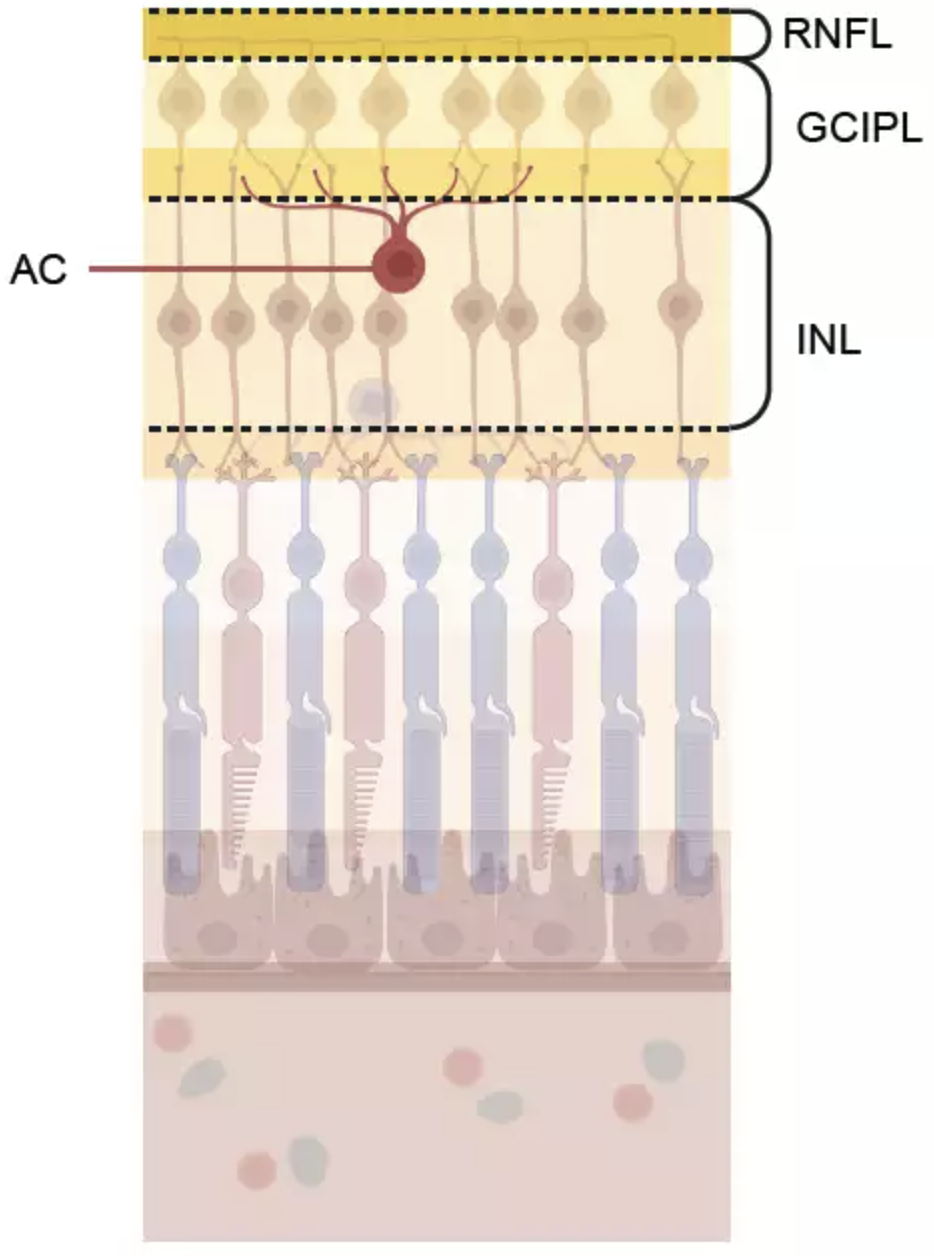
Retinale Nervenschicht (RNFL), Ganglienzell- und innere plexiforme Schicht (GCIPL), innere Körnerschicht (INL) und Amakrinzellen (AC)
der Netzhaut. Die GCIPL, die synaptische Schicht der AC, war bei höherem genetischen Risiko für Schizophrenie dünner.
© Boudriot et al.
Risikogene für Schizophrenie mit Amakrinzellen assoziiert
Bei zwei Erkrankungen zeigten die Daten einen deutlichen Zusammenhang: Erstens waren Risikogene für die Autoimmunerkrankung MS mit retinalen Immunzellen assoziiert. Zweitens standen Risikogene für Schizophrenie in Verbindung mit einer bestimmten Klasse von Netzhautneuronen, den Amakrinzellen. Sie sind an Prozessen in den Synapsen beteiligt und bestimmen unter anderem die Fähigkeit der Neuronen, miteinander zu kommunizieren.
Neuronale Kommunikation in der Netzhaut von Schizophrenie-PatientInnen beeinträchtigt
Somit konnten Raabe, Boudriot und ihr Team auf zellulärer und struktureller Ebene zeigen, dass die neuronale Kommunikation in der Netzhaut von Schizophrenie-PatientInnen beeinträchtigt ist. „Die Entdeckung dieser Beeinträchtigung im Auge deutet darauf hin, dass sich Prozesse der Netzhaut und des Gehirns sehr ähnlich sind - das würde die Netzhaut zu einem hervorragenden Ort für die Untersuchung neuronaler Erkrankungen machen, da wir die Netzhaut von PatientInnen mit einer viel höheren Auflösung untersuchen können als das Gehirn“, erklärt Raabe. Biologische Mechanismen psychiatrischer Erkrankungen zu verstehen, soll Forschenden helfen, wirksamere und individuellere Behandlungen zu entwickeln.
Quelle: Max-Planck-Institut (MPI) für Psychiatrie