Stanford-Forscher bestimmen zum ersten Mal das molekulare Alter des Auges
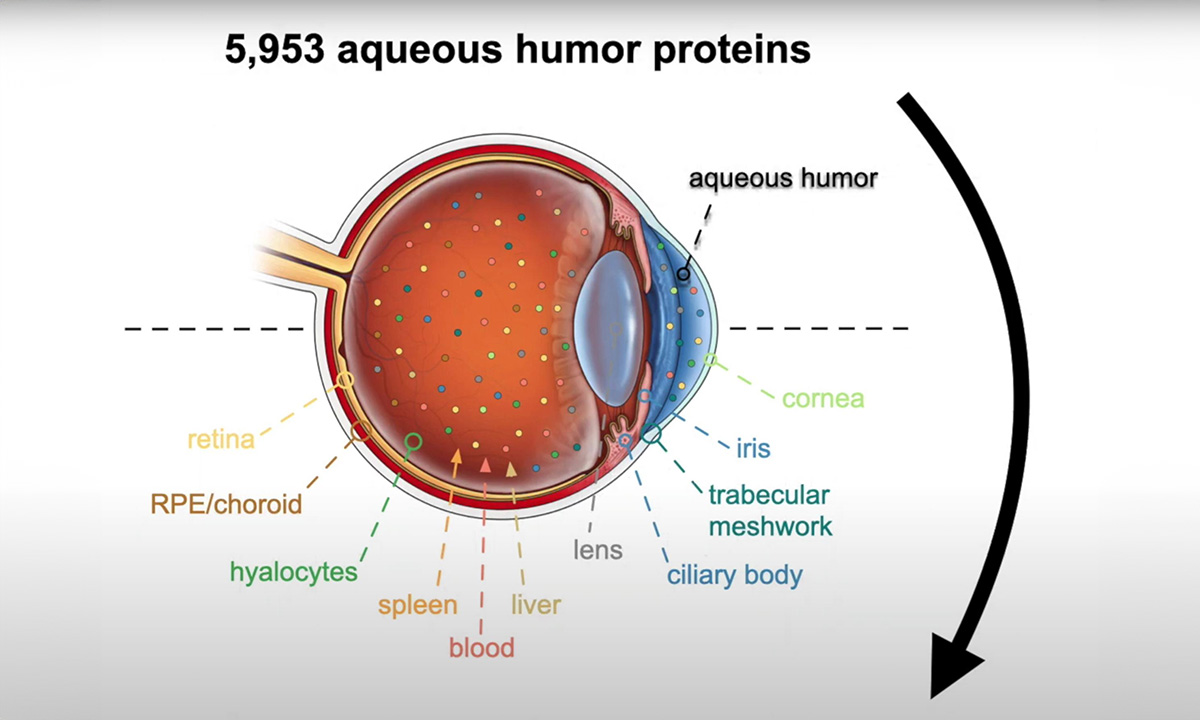
Eine Gruppe von Forschern der Stanford University hat durch die Analyse von Proben aus Kammerwasser oder Glaskörper fast 6.000 Proteine aus den verschiedenen Zelltypen des Auges kartiert.
Wie die Fachzeitschrift Cell berichtet, verwendeten die Wissenschaftler ein KI-Modell, um aus diesen Daten eine „Proteom-Uhr“ zu erstellen, die in der Lage ist, das Alter eines gesunden Menschen auf der Grundlage seines Proteinprofils vorherzusagen. Das Proteom, also die Gesamtheit aller Proteine in einem Gewebe oder einer Zelle unter definierten Bedingungen und zu einem definierten Zeitpunkt, lässt Rückschlüsse auf das biologische Alter zu.
Die „Proteom-Uhr“ zeigte, dass Erkrankungen wie diabetische Retinopathie und Uveitis die Alterung in bestimmten Zelltypen beschleunigen. Interessanterweise identifizierten die Forscher in der Augenflüssigkeit auch Proteine, die mit der Parkinson-Krankheit in Verbindung gebracht werden, was möglicherweise einen Weg zur frühzeitigen Diagnose der Parkinson-Krankheit eröffnet.
„Das Erstaunliche am Auge ist, dass wir in das Innere blicken und Krankheiten in Echtzeit beobachten können“, erklärt Erstautor Dr. Vinit Mahajan von der Stanford University, eine der forschungsstärksten und renommiertesten Universitäten der Welt. Mahajan ist dort als Professor, Glaskörper- und Netzhautchirurg und Wissenschaftler in der Abteilung für Augenheilkunde tätig. Zudem leitet er das Molecular Surgery and Omics Laboratory, in dem Moleküle identifiziert werden, die an vitreoretinalen Erkrankungen beteiligt sind. „Unser Hauptaugenmerk lag darauf, anatomische Veränderungen mit dem in Verbindung zu bringen, was auf molekularer Ebene in den Augen unserer Patienten passiert.“
Liquid Biopsy
Die Entnahme von Proben aus den Augen lebender Patienten stellt eine große Herausforderung dar. Ein alternativer Ansatz ist die Liquid Biopsy oder Flüssigbiopsie, bei der Flüssigkeitsproben aus Bereichen in der Nähe der relevanten Zellen oder Gewebe entnommen werden.
Flüssigbiopsien können zwar Aufschluss über das Vorhandensein von Proteinen in der Zielregion geben, doch stoßen sie bei der Quantifizierung zahlreicher Proteine in den relativ kleinen Flüssigkeitsmengen an ihre Grenzen. Außerdem konnten sie keine Informationen über den zellulären Ursprung dieser Proteine liefern, was für die Diagnose und Behandlung von Krankheiten von entscheidender Bedeutung ist.
Dr. Vinit Mahajan. Bild: John Barreto
Spezielle Software identifiziert 5.953 Proteine
Um die Proteinproduktion verschiedener Zelltypen im Auge umfassend analysieren zu können, setzte Mahajans Forschungsteam eine hochentwickelte Methode zur Charakterisierung von Proteinen in 120 Flüssigbiopsien ein. Diese Proben hatte es aus dem Kammerwasser oder dem Glaskörper von Patienten gewonnen, die sich einer Augenoperation unterzogen hatten. Insgesamt identifizierten sie 5.953 Proteine – das Zehnfache der bisher in analogen Studien dokumentierten Anzahl an Proteinen. Mit Hilfe ihres maßgeschneiderten Softwaretools TEMPO konnten die Forscher jedes Protein zu bestimmten Zelltypen zurückverfolgen.
TEMPO steht für Tracing Expression of Multiple Protein Origins. Dieses Tool verbindet die Analyse des Proteoms der Flüssigbiopsien und die Transkriptomik – die Analyse der Gesamtheit aller aktiven, exprimierten Gene einer Zelle – mit Künstlicher Intelligenz. Das Forschungsteam betrachtet TEMPO als äußerst leistungsfähiges Instrument zur Untersuchung von Krankheitsmechanismen auf Zellebene bei lebenden Menschen. Das Tool könnte die Identifizierung zellulärer Mechanismen, die Verbesserung der Diagnose, die Optimierung klinischer Studien und die Erforschung des Zusammenspiels zwischen Alterung und Krankheit entscheidend voranbringen.
The TEMPO method: Tracing Expression of Multiple Protein Origins
„Die Proteinkonzentration in der Augenflüssigkeit ist etwa 400-mal niedriger als im Plasma, aber ein verbesserter Proteomik-Ansatz war ein Wendepunkt. Wir konnten fast 6000 Proteine nachweisen, zehnmal mehr als zuvor gemessen worden waren. Durch die Kombination mit der Einzelzell-Transkriptomik erhielten wir einen Überblick über die zellspezifische Genexpression im Auge," so Dr. Vinit Mahajan.
Molekulares Alter des Auges anhand von Proteinen vorhersagen
Um den Zusammenhang zwischen Krankheit und molekularem Altern zu untersuchen, entwickelten die Wissenschaftler ein KI-Modell für maschinelles Lernen, das das molekulare Alter des Auges auf der Grundlage einer Untergruppe von 26 Proteinen vorhersagen kann. Bemerkenswert ist, dass dieses Modell das Alter gesunder Augen genau vorhersagte und gleichzeitig einen bemerkenswerten Zusammenhang zwischen Krankheiten und signifikanter molekularer Alterung aufdeckte.
Im Falle der diabetischen Retinopathie wurde das Ausmaß der Alterung mit dem Fortschreiten der Krankheit immer deutlicher, wobei bei Personen mit proliferativer diabetischer Retinopathie eine Beschleunigung der Alterung um bis zu 30 Jahre beobachtet wurde. Bemerkenswerterweise traten diese Alterungserscheinungen manchmal schon vor dem Auftreten klinischer Symptome im Zusammenhang mit der Grunderkrankung auf und blieben auch bei Patienten bestehen, die erfolgreich behandelt worden waren.
Frühere Diagnose der Parkinson-Krankheit?
Darüber hinaus identifizierten die Forscher mehrere Proteine, die mit der Parkinson-Krankheit in Verbindung stehen. Diese Proteine werden in der Regel erst nach dem Tod des Patienten identifiziert. Die derzeitigen Diagnosemethoden sind nicht in der Lage, sie nachzuweisen, was die Diagnose der Parkinson-Krankheit zusätzlich erschwert. Das Screening dieser Marker in der Augenflüssigkeit könnte eine frühere Diagnose der Parkinson-Krankheit ermöglichen und die anschließende therapeutische Überwachung erleichtern.
Die Autoren sagen, dass diese Ergebnisse darauf hindeuten, dass das Altern organ- oder sogar zellspezifische Muster aufweisen könnte, was potenzielle Fortschritte in der Präzisionsmedizin und bei der Planung klinischer Studien ermöglichen würde. Julian Wolf, Erstautor und Augenarzt an der Stanford University, betont: „Diese Entdeckungen unterstreichen die unterschiedlichen Alterungsgeschwindigkeiten in unseren Organen. Der mögliche Einsatz von gezielten Anti-Aging-Medikamenten könnte die nächste Phase der präventiven Präzisionsmedizin darstellen.“
„Wenn wir molekulare Therapien einsetzen wollen, sollten wir die Moleküle in unseren Patienten analysieren“, erklärt Mahajan. „Ich denke, dass eine Neuklassifizierung der Patienten auf der Grundlage ihrer molekularen Muster und der betroffenen Zellen die klinischen Studien, die Auswahl der Medikamente und die Ergebnisse der Behandlung wirklich verbessern kann.
Als Nächstes planen die Forscher, Proben von einer größeren Anzahl von Patienten zu analysieren, die ein breiteres Spektrum von Augenkrankheiten aufweisen. Sie betonen auch die potenzielle Anwendbarkeit ihrer Methode bei der Charakterisierung von schwierig zu beprobenden Geweben. So könnte der Ansatz beispielsweise auf Flüssigbiopsien von Liquor für Untersuchungen des Gehirns, von Synovialflüssigkeit für Gelenk- und von Urin für Nierenuntersuchungen angewendet werden.
Quelle: CELL PRESS / Stanford Medicine
Liquid biopsy proteomics combined with AI identifies cellular drivers of eye aging and disease in vivo, Cell (2023).