National Eye Institute: Forscher nutzen 3D-Bioprinting zur Herstellung von Augengewebe
Neues Modell zur Untersuchung der Entstehung von altersbedingter Makuladegeneration und anderen Augenkrankheiten.
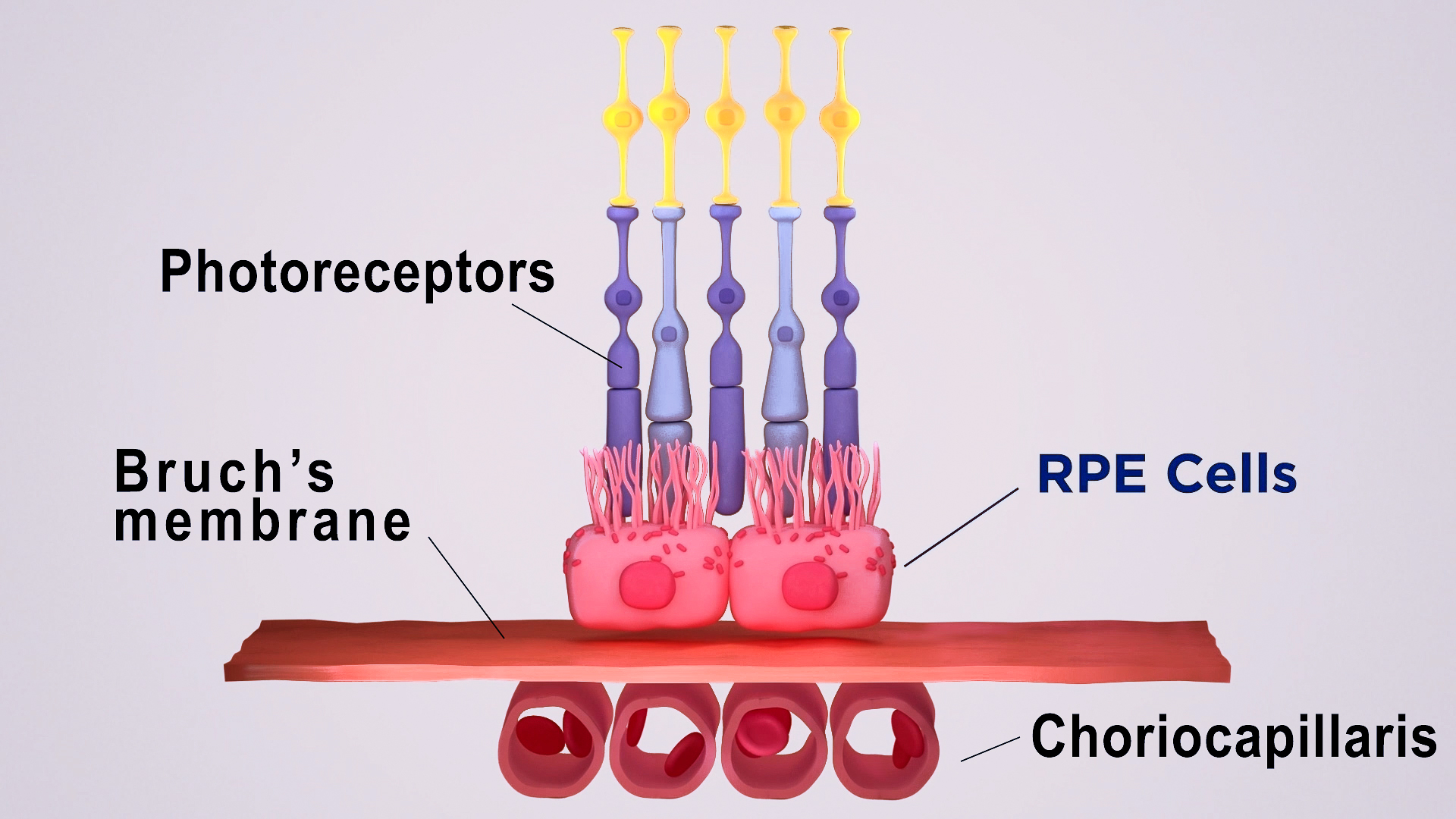
US-Wissenschaftler nutzten Stammzellen von Patienten und 3D-Bioprinting zur Herstellung von Augengewebe, das das Verständnis der Mechanismen von Netzhauterkrankungen verbessern wird. Das Forscherteam des National Eye Institute (NEI), das zu den National Institutes of Health gehört, druckte eine Kombination von Zellen, die die äußere Blut-Retina-Schranke bilden – Augengewebe, das die lichtempfindlichen Fotorezeptoren der Netzhaut versorgt. Diese Technik könnte die Möglichkeit bieten, einen theoretisch unbegrenzten Vorrat an Patientengewebe zur Erforschung degenerativer Netzhauterkrankungen wie der altersbedingten Makuladegeneration (AMD) herzustellen.
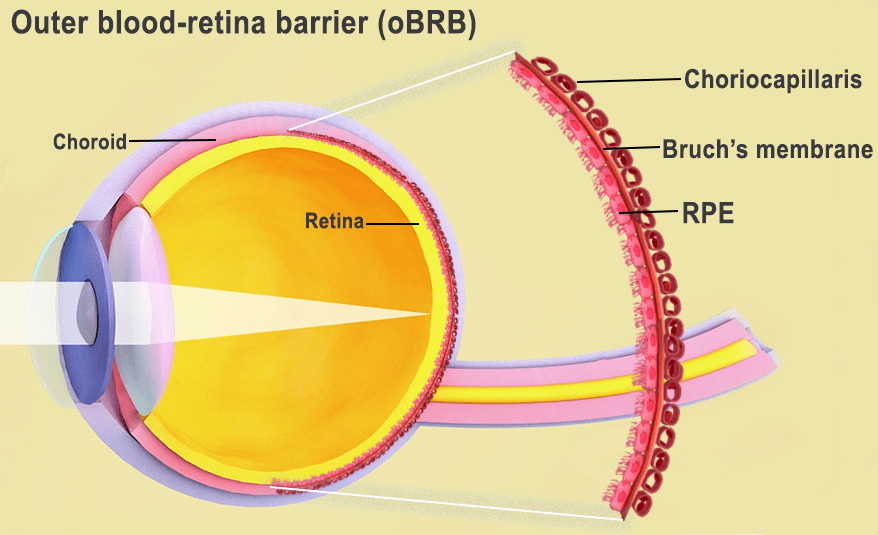
Äußere Blut-Retina-Schranke: Schnittstelle zwischen Netzhaut und Aderhaut. Bild: National Eye Institute.
„Wir wissen, dass AMD in der äußeren Blut-Retina-Schranke beginnt“, sagte Kapil Bharti, Ph.D., der die NEI-Abteilung Ocular and Stem Cell Translational Research leitet. „Die Mechanismen der Entstehung von AMD und des Verlaufs bis hin zu fortgeschrittenen trockenen und feuchten Stadien werden jedoch aufgrund des Mangels an physiologisch relevanten menschlichen Modellen nach wie vor schlecht verstanden."
Die äußere Blut-Retina-Schranke besteht aus dem retinalen Pigmentepithel (RPE), das durch die Bruch'sche Membran von der blutgefäßreichen Lamina choroidocapillaris getrennt ist. Die Bruch'sche Membran reguliert den Austausch von Nähr- und Abfallstoffen zwischen der Lamina choroidocapillaris und dem RPE. Bei AMD bilden sich außerhalb der Bruch'schen Membran Lipoproteinablagerungen, so genannte Drusen, die ihre Funktion beeinträchtigen. Mit der Zeit bricht das RPE zusammen, was zur Degeneration der Fotorezeptoren und zum Sehverlust führt.
Bharti und seine Kollegen kombinierten drei unreife Zellarten der Aderhaut in einem Hydrogel: Perizyten und Endothelzellen, die wichtige Bestandteile der Kapillaren sind, sowie Fibroblasten, die dem Gewebe Struktur verleihen. Anschließend druckten die Wissenschaftler das Gel auf ein biologisch abbaubares Gerüst. Innerhalb weniger Tage begannen die Zellen zu einem dichten Kapillarnetz zu reifen.
Am neunten Tag setzten die Wissenschaftler retinale Pigmentepithelzellen auf der anderen Seite des Gerüsts ein. Das gedruckte Gewebe erreichte seine volle Reife an Tag 42. Gewebeanalysen sowie genetische und funktionelle Tests zeigten, dass das gedruckte Gewebe ähnlich aussah und sich ähnlich verhielt wie die native äußere Blut-Retina-Schranke. Unter induziertem Stress zeigte das gedruckte Gewebe Muster der frühen AMD wie Drusenablagerungen unter dem RPE und ein Fortschreiten zur späten trockenen AMD, bei der ein Gewebeabbau beobachtet wurde. Niedriger Sauerstoffgehalt führte zu einer feuchten AMD-ähnlichen Erscheinung mit einer Hyperproliferation von Aderhautgefäßen, die in die Sub-RPE-Zone eindrangen. Anti-VEGF-Medikamente, die zur Behandlung der AMD eingesetzt werden, unterdrückten diese Gefäßüberwucherung und -migration und stellten die Gewebemorphologie wieder her.
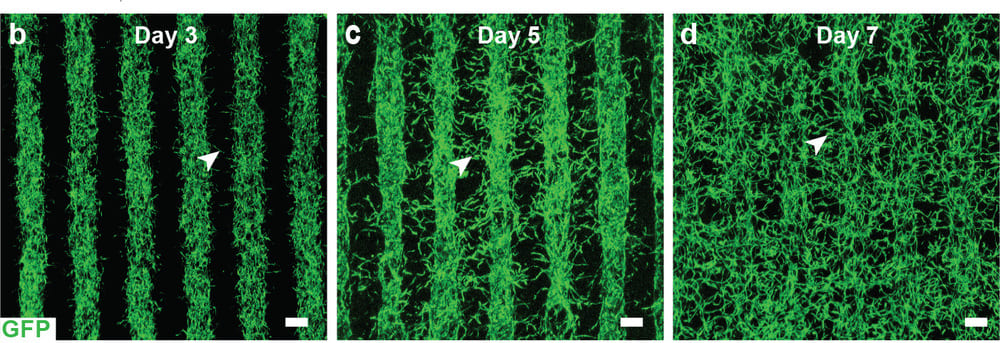
Wachstum von Blutgefäßen durch gedruckte Reihen einer Endothel-Perizyten-Fibroblasten-Zellmischung. Am 7. Tag bilden die Blutgefäße ein Netz von Kapillaren. Bild: Kapil Bharti
"Durch das Drucken von Zellen ermöglichen wir den Austausch von zellulären Informationen, die für eine normale Anatomie der äußeren Blut-Retina-Schranke notwendig sind", so Bharti. "Zum Beispiel induziert die Anwesenheit von RPE-Zellen Veränderungen in der Genexpression von Fibroblasten, die zur Bildung der Bruchschen Membran beitragen - etwas, das schon vor vielen Jahren vermutet wurde, aber bis zu unserem Modell nicht bewiesen war.
Zu den technischen Herausforderungen, mit denen sich Bhartis Team auseinandersetzte, gehörten die Herstellung eines geeigneten biologisch abbaubaren Gerüsts und die Erzielung eines konsistenten Druckmusters durch die Entwicklung eines temperatursensitiven Hydrogels, das in kaltem Zustand deutliche Reihen bildet, sich aber auflöst, wenn das Gel erwärmt wird. Eine gute Reihenkonsistenz ermöglichte ein präziseres System zur Quantifizierung der Gewebestrukturen. Außerdem optimierten sie das Verhältnis der Zellmischung aus Perizyten, Endothelzellen und Fibroblasten.
Co-Autor Marc Ferrer, Ph.D., Direktor des 3D Tissue Bioprinting Laboratory am National Center for Advancing Translational Sciences des NIH, und sein Team lieferten das Fachwissen für die Biofabrikation der äußeren Blut-Retina-Schranke.
„Unsere gemeinsamen Bemühungen haben zu sehr relevanten Netzhautgewebemodellen für degenerative Augenkrankheiten geführt", sagte Ferrer. „Solche Gewebemodelle haben viele potenzielle Einsatzmöglichkeiten für translationale Anwendungen, einschließlich der Entwicklung von Therapeutika".
Bharti und seine Mitarbeiter verwenden gedruckte Modelle der Blut-Retina-Schranke, um AMD zu untersuchen, und sie experimentieren damit, zusätzliche Zelltypen in den Druckprozess einzubeziehen, wie z. B. Immunzellen, um das native Gewebe besser zu reproduzieren.
3D outer retina barrier uncovers RPE-dependent choroidal phenotype in advanced macular degeneration. Nature methods.
Quelle: National Eye Institute (NEI)