Crosslinking: Forschende entschlüsseln Funktionsweise
Wissenschaftler:innen des Naturwissenschaftlichen und Medizinischen Instituts (NMI) in Reutlingen haben die Wirkweise der Kollagenvernetzung bei der Behandlung von Defekten der Hornhaut entschlüsselt. Die Ergebnisse eröffnen neue Chancen bei der Anwendung von Kollagen in der Medizin.
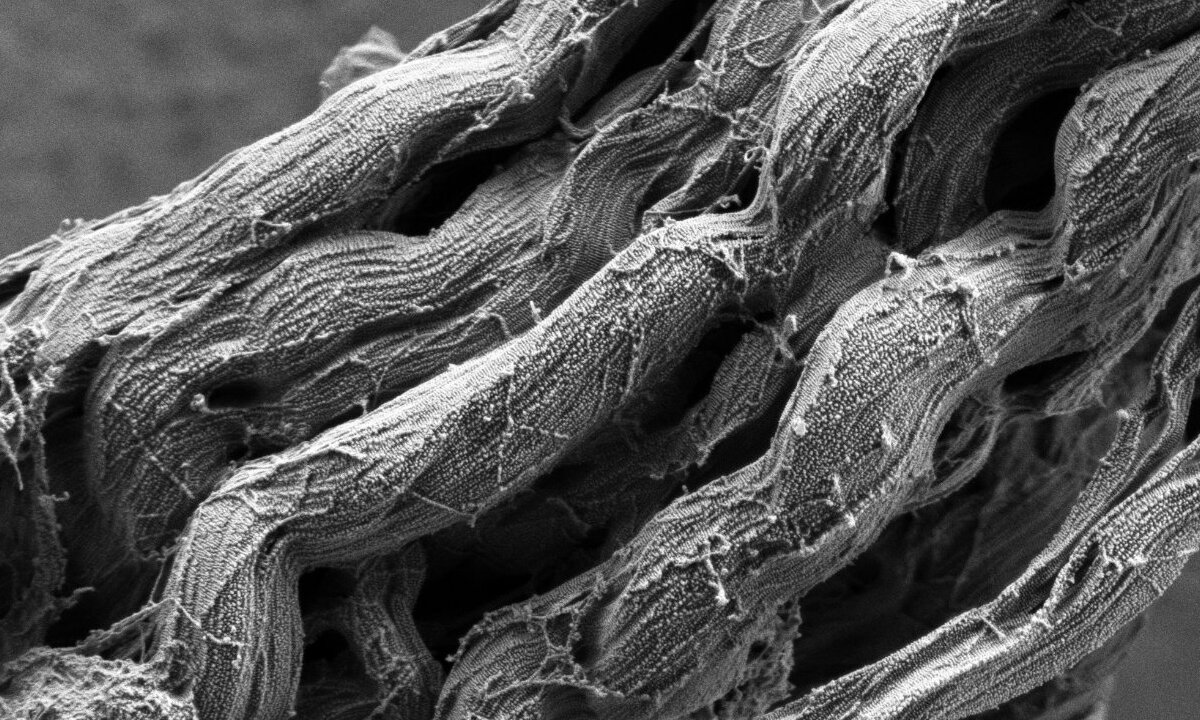
Bereits seit den 1990er Jahren wird Kollagen in der Augenheilkunde eingesetzt – etwa beim Kollagen-Crosslinking der Hornhaut mit Riboflavin und UV-A (CXL) zur Behandlung des Keratokonus. Dafür wird die Hornhaut zunächst mit Riboflavin behandelt und die Stelle dann mit UV-A-Licht bestrahlt. Dadurch entstehende freie Radikale sorgen dann dafür, dass zusätzliche Vernetzungen innerhalb der Kollagenfasern der Hornhaut entstehen; diese wird dadurch stabiler. Trotz der klinischen Anwendung sind weitere Untersuchungen erforderlich, da der detaillierte Mechanismus nicht klar ist und ein verfeinertes Herstellungsverfahren notwendig ist.
Forschende des Naturwissenschaftlichen und Medizinischen Instituts (NMI) in Reutlingen um Lu Fan können die Wirkweise dieser Technik jetzt zuverlässig erklären. „Unsere Ergebnisse schließen eine regulatorische Lücke und eröffnen zugleich neue Chancen in der Anwendung von Kollagen, auch über die Augenheilkunde hinaus“, erklärt Wissenschaftlerin Lu Fan. Die Studie „Deciphering UVA/Riboflavin Collagen Crosslinking: A Pathway to Improve Biomedical Materials“ verbessert das Verständnis von UV-A/R-vernetztem Kollagen und konzentriert sich auf die Identifizierung der primären Vernetzungsstellen unter Verwendung von sieben synthetischen Peptiden und die Erforschung der Wege der Riboflavin-vermittelten Vernetzung.
Riboflavin: Katalysator und Inhibitor im Vernetzungsprozess
Die Ergebnisse zeigen, dass Tyrosinreste wichtige Vernetzungsstellen sind und Riboflavin eine doppelte Rolle als Katalysator und kompetitiver Inhibitor im Vernetzungsprozess spielt. Darüber hinaus weist die UV-A/R-vernetzte Kollagenmatrix im Vergleich zu chemisch vernetzten Kollagenmatrizen ein harmonischeres Gleichgewicht zwischen Stabilität und Abbaubarkeit auf, verbunden mit überlegenen mechanischen Eigenschaften und einer verbesserten Biokompatibilität. In-vivo-Experimente bestätigen zudem die ausgezeichnete Biokompatibilität, die Verringerung der Gewebeentzündung und die Förderung der Geweberegeneration. Die Forschungsarbeiten liefern entscheidende Erkenntnisse über die Mechanismen der Kollagenvernetzung und ebnen den Weg für die Entwicklung hochentwickelter Biomaterialien auf Kollagenbasis, die für biomedizinische Anwendungen maßgeschneidert sind.
Structural and mechanical characterization of collagen pre- and post-UVA/riboflavin treatment. A) Molecular model of the collage type I triple helix structure, the fundamental building block of collagen matrices. B) SDS-PAGE analysis depicting the characterization of collagen type I extracted from rat tail (R-col) and porcine skin (P-col). C) Circular dichroism (CD) spectra of R-col and P-col, with ellipticity indicating preservation of the collagen secondary structure. D) Scanning electron microscopy images presenting the morphological examination of non-crosslinked collagen and UVA/R crosslinked collagen in their hydrated-frozen state (a,b), as well as in their lyophilized state (c,d). NMI
„Diese Erkenntnisse erlauben es uns, die Behandlung zu optimieren, also zugleich zuverlässiger und schonender zu machen“, so Xin Xiong, NMI-Wissenschaftler aus dem Team der Forschenden. Durch die nun mögliche präzisere Dosierung werden gleichzeitig die potenziellen Risiken minimiert. Die Forschenden blicken aber bereits über die Behandlung der Hornhaut hinaus. Da Kollagen in vielen Körperteilen vorkommt, könnte darin auch Potenzial für die Behandlung weiterer Krankheiten liegen. Diese Reparatur bzw. die Regeneration von kollagenbasiertem Gewebe scheint etwa in der Wundheilung, bei Knochenersatz, in der Zahnmedizin und bei Herz-Kreislauf-Erkrankungen denkbar. "Unsere In-vivo-Studien an BALB/c-Mäusen haben die Biokompatibilität und die funktionelle Wirksamkeit von UVA/R-vernetztem Kollagen bestätigt und sein überragendes Potenzial als Biomaterial für therapeutische Zwecke untermauert", heißt es in der Studie.
In Zukunft könnte die Erforschung der UV-A/R-Vernetzung transformative Auswirkungen auf ein breites Spektrum kollagenbasierter Materialien haben und dem Kollagen-Engineering im Rahmen des Tissue-Engineering neu Möglichkeiten eröffnen. Die nachgewiesene Biokompatibilität und mechanische Festigkeit von UV-A/R-vernetztem Kollagen machen jetzt weitere Forschungen zu seiner Langzeitstabilität und Leistung in verschiedenen biologischen Umgebungen erforderlich.
MIK als Partner von KMU
Die Ergebnisse sind auch ein Erfolg für das MDR- & IVDR-Kompetenzzentrum (MIK) von NMI und Hahn-Schickard. Ziel des MIK ist unter anderem, noch nicht verfügbare Analytik- und Prüfmethoden zu entwickeln sowie Unternehmen bei der Entwicklung von innovativen Ideen bis hin zu ihrer Zertifizierung zu unterstützen. Das MIK entstand als Reaktion auf verschärfte Regeln über Medizinprodukte (MDR) und In-vitro-Diagnostika (IVDR), die besonders kleine und mittlere Unternehmen der Branche vor große Herausforderungen stellen. Das MIK wurde initial gefördert durch das Ministerium für Wirtschaft, Arbeit und Tourismus Baden-Württemberg.
Über das NMI:
Das NMI Naturwissenschaftliche und Medizinische Institut in Reutlingen ist eine außeruniversitäre Forschungseinrichtung und betreibt anwendungsorientierte Forschung an der Schnittstelle von Bio- und Materialwissenschaften. Es verfügt über ein einmaliges, interdisziplinäres Kompetenzspektrum für F&E- sowie Dienstleistungsangebote für regional und international tätige Unternehmen. Dabei richtet sich das Institut gleichermaßen an die Gesundheitswirtschaft wie an Firmen aus dem Fahrzeug-, Maschinen- und Werkzeugbau. Zugleich unterstützt das NMI aktiv Ausgründungen aus dem Institut.
Quelle: Naturwissenschaftlichen und Medizinischen Instituts (NMI)
Originalpublikation: Deciphering UVA/Riboflavin Collagen Crosslinking: A Pathway to Improve Biomedical Materials
